当硫酸溶解时,其分子分解成正氢离子(2H +)和硫酸根负离子(SO 4 -)并自由移动。如果两个电极浸入溶液中并连接到直流电源,则氢离子带正电并移向电极并连接到电源的负极端子。带负电的SO 4 -离子向连接到供电干线正极端子(即阳极)的电极移动。
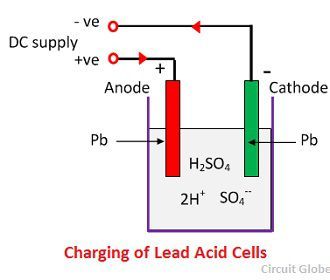 每个氢离子从阴极获取一个电子,每个硫酸根离子从阳极获取两个负离子并与水反应生成硫酸和氢酸。
每个氢离子从阴极获取一个电子,每个硫酸根离子从阳极获取两个负离子并与水反应生成硫酸和氢酸。
由上述方程式产生的氧气与氧化铅反应并形成过氧化铅 (PbO 2 )。因此,在充电过程中,铅阴极仍为铅,但铅阳极转化为过氧化铅,呈巧克力色。
如果直流电源断开并且电压表连接在电极之间,它将显示它们之间的电位差。如果电线连接电极,则电流将通过外部电路从正极板流向负极板,即电池能够提供电能。
当电池完全放电时,阳极为过氧化铅 (PbO 2 ),阴极为金属海绵铅 (Pb)。当电极通过电阻连接时,电池放电和电子流动的方向与充电时相反。
氢离子移动到阳极并到达阳极从阳极接收一个电子并成为氢原子。氢原子与 PbO 2接触,因此它会攻击并形成硫酸铅 (PbSO 4 ),根据化学方程式,它的颜色和水呈白色。
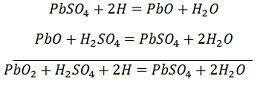
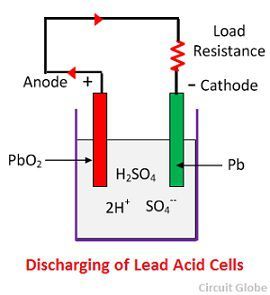 每个硫酸根离子(SO 4 -)向阴极移动并到达那里放弃两个电子成为自由基SO 4,攻击金属铅阴极并根据化学方程式形成白色的硫酸铅。
每个硫酸根离子(SO 4 -)向阴极移动并到达那里放弃两个电子成为自由基SO 4,攻击金属铅阴极并根据化学方程式形成白色的硫酸铅。
为了充电,阳极和阴极连接到直流电源的正极和负极。硫酸分子分解成 2H +和 SO 4 -离子。带正电的氢离子向阴极移动并从那里接收两个电子并形成氢原子。根据化学方程式,氢原子与硫酸铅阴极反应形成铅和硫酸。
![]()
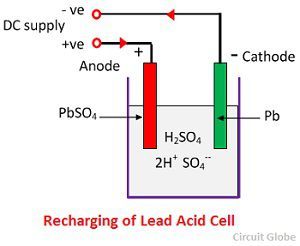 SO 4 -离子移动到阳极,放弃其额外的两个电子成为自由基SO 4,与硫酸铅阳极反应,根据化学方程式生成过氧化铅和硫酸铅。
SO 4 -离子移动到阳极,放弃其额外的两个电子成为自由基SO 4,与硫酸铅阳极反应,根据化学方程式生成过氧化铅和硫酸铅。![]() 充电和放电由下面给出的单个可逆方程表示。
充电和放电由下面给出的单个可逆方程表示。
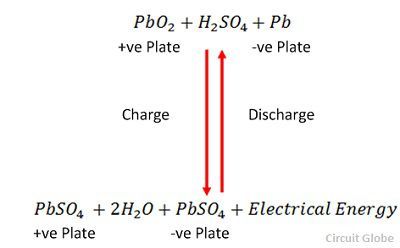 该等式应向下读取放电,向上读取充电。
该等式应向下读取放电,向上读取充电。
联系人:余先生
手 机:198-5307-5821
邮 箱:batteryltd@sina.com